
Sappiamo oramai da tempo che l’inositolo fa parte delle non-vitamine B ma è strettamente collegato con la colina e la biotina. Studi su animali hanno mostrato che la vitamina B6, l’acido folico, l’acido pantotenico e il PABA hanno anche un’associazione di attività molto stretta con l’inositolo.
Il mioinositolo è l’unico costituente attivo, dal punto di vista nutritivo, del fosfatidilinositolo.
L’inositolo è attivo nelle membrane cellulari e nell’inviare messaggi che segnalano il controllo delle funzioni cellulari nel sistema nervoso. Come la colina, anche l’inositolo è presente nella lecitina.
I grassi vengono spostati dal fegato alle cellule con l’aiuto della lecitina; l’inositolo, quindi, contribuisce al metabolismo dei grassi e aiuta a ridurre il tasso di colesterolo nel sangue.
Combinato alla colina, impedisce l’indurimento dei grassi nelle arterie e protegge:
- il fegato
- i reni
- il cuore.
Si è riscontrata la sua utilità anche nel nutrimento delle cellule cerebrali.
Grandi quantità di inositolo si trovano nei:
- nervi del midollo spinale
- nel cervello
- nel fluido cerebro-spinale.
E’ necessario per la crescita e la sopravvivenza delle cellule del:
- midollo osseo
- per le membrane oculari
- per gli intestini
E’ vitale per la crescita dei capelli e può prevenire il loro sfibramento e la calvizie. L’inositolo si trova nei:
- cereali integrali non trattati
- negli agrumi
- nel lievito di birra
- nelle melasse crude non raffinate
- nel fegato (per maggiori informazioni vedi la tabella sulla composizione degli alimenti).
ASSIMILAZIONE ED IMMAGAZZINAMENTO
Circa il 7% di inositolo ingerito viene trasformato in glucosio. La sua efficacia nell’alleviare la chetosi, cioè l’incompleto metabolismo di acidi grassi, è solo un terzo di quella del glucosio. Il mioinositolo si può trovare nei negozi di alimenti naturali ed è l’unico tipo di inositolo che il corpo può usare. La lecitina in commercio ne contiene solo piccole quantità. L’estere di fosfato dell’inositolo impedisce l’assorbimento dello zinco, si raccomanda quindi l’assunzione di inositolo puro.
La quantità giornalmente escreta attraverso le urine è minima, circa 37 milligrammi in media. I diabetici eliminano più inositolo dei non diabetici. Grandi quantità di caffè possono diminuire la scorta di inositolo presente nell’organismo.
Gli alimenti ricchi di inositolo sono:
- la frutta fresca
- la frutta secca
- i legumi
- i cereali.
La frutta e la verdura fresca contengono più mioinositolo rispetto ai prodotti surgelati, in scatola o senza sale. Un melone di dimensioni medie ne contiene 335 mg mentre una fetta di pane di grano integrale 288 mg. Un’arancia ha 307 mg, una mezza tazza di succo d’arancia concentrato 245 mg, mezzo pompelmo 200 mg e mezza tazza di succo di pompelmo concentrato 456 mg.
EFFETTI DA CARENZA E SINTOMI
Ricerche eseguite su cellule di lievito hanno mostrato che, quando private di inositolo, i processi metabolici sono impediti nel loro funzionamento e conseguentemente la maggior parte delle cellule muoiono. In altri studi, la carenza di inositolo nelle cellule di lievito porta a malformazioni delle pareti delle cellule e all’impossibilità delle cellule figlie di separarsi dalla cellula madre. Si è anche riscontrata l’inibizione della fermentazione e dell’attività di ossidazione, così come una diminuzione del livello di coenzimi nucleotidi.
La caffeina può portare a una carenza di inositolo nell’organismo. L’uso di sulfamidici incrementa il fabbisogno di inositolo. La diuresi, come nel caso di diabete insipido e nell’eccessiva assunzione di acqua, può causare una perdita di inositolo.
La sua carenza può causare stitichezza, eczema e anomalie degli occhi. Essa contribuisce alla caduta dei capelli e ad un alto tasso di colesterolo nel sangue, che può manifestarsi con malattie cardiache e arteriose. Una carenza di inositolo può avere effetti negativi sul sistema nervoso dei diabetici che soffrono di neuropatie periferiche.
EFFETTI BENEFICI NELLE MALATTIE
L’inositolo è benefico nel trattamento della stitichezza perché ha un effetto stimolante sull’azione muscolare del canale alimentare. E’ anche consigliato alle persone che soffrono di calvizie ed è essenziale per contribuire ad abbassare il livello di colesterolo nel sangue, ed è quindi un fattore di protezione nei confronti delle malattie cardiovascolari. Aiuta ad eliminare i grassi dal fegato nei pazienti che devono essere operati di cancro allo stomaco.
L’uso di inositolo abbinato alla colina ha un effetto positivo sulle neuropatie diabetiche periferiche. La stessa combinazione è consigliata nell’alimentazione femminile. Una dose di 500 mg di inositolo e 1000 mg di colina aiuta nei casi di ipoglicemia. L’inositolo, la vitamina E e l’octacosanolo sono conosciuti per i loro effetti positivi sulla paralisi cerebrale quando non ci siano allergie. La trasmissione nervosa è migliorata dall’assunzione di vitamine del complesso B e inositolo.
Il dott. Carl Pfeiffer, nel suo Brain Bio Center, ha studiato gli effetti dell’inositolo sulle onde cerebrali. I risultati hanno mostrato che questa vitamina possiede un potere ansiolitico simile a quello del Librium.
Il dott. Pfeiffer ritiene che le persone che assumono Librium o Valium potrebbero interrompere il trattamento assumendo invece una dose adeguata di inositolo. Poiché l’inositolo ha un effetto simile a quello dei sedativi, non solo agisce come tranquillante senza nessun effetto collaterale, ma può essere efficace contro l’insonnia. Esso risolve casi di lieve ipertensione abbassando gradualmente la pressione del sangue; è raccomandato un grammo al mattino e uno alla notte.
L’inositolo è utile per la cura della schizofrenia, dell’ipoglicemia e per le persone con un alto tasso di rame e un basso tasso di zinco nel siero.
Si è scoperto che l’inositolo previene l’ingrossamento del fegato.
L’INOSITOLO PUO’ ESSERE EFFICACE NELLA CURA DELLE SEGUENTI MALATTIE:
Organi/Malattie:
- Apparato intestinale/ Stitichezza
- Capelli/cuoio capelluto Calvizie
- Cervello/sistema nervoso Ansia
- Insonnia
- Neuropatie diabetiche periferiche
- Schizofrenia
- Tensione nervosa
- Trasmissione nervosa
- Vertigini
- Fegato/Cirrosi epatica
- Ingrossamento del fegato
- Occhio Glaucoma
- Polmoni/Apparato respiratorio Asma
- Sangue/apparato circolatorio
- Alto tasso di colesterolo
- Arteriosclerosi
- Aterosclerosi
- Ictus
- Ipertensione
- Ipoglicemia
- Malattie cardiovascolari
- Stomaco Cancro (terapia pre-operatoria)
- Gastrite
- Generale Alimentazione femminile
- Sovrappeso e obesità
- Paralisi cerebrale
Non si intende far utilizzare le nozioni contenute in queste pagine per scopi diagnostici o prescrittivi. Per qualsiasi trattamento o diagnosi di malattia, rivolgetevi ad un medico competente.
Fonte: INOSITOLO E AUTISMO
Le informazioni sono tratte da "Almanacco della Nutrizione" di Gayla J. Kirschmann e John D. Kirshmann edito da Alfa Omega Editrice - Via San Damaso,23 - 00165 Roma
INSULINA E AUTISMO
Le condizioni dello spettro autistico (ASD) sono causate prevalentemente da fattori genetici con l´addizionale contributo di fattori di rischio ambientali. Entrambe le cause possono avere molteplici origini e sviluppi e ancora non sono perfettamente conosciute.
L´individuazione dei fattori di rischio ambientali può migliorare sia la prevenzione che lo sviluppo di terapie adeguate. Tra i fattori oggetto di esame c´è la il circuito neurologico in cui è coinvolta l´insulina e quindi sia la familiarità con malattie metaboliche, soprattutto nella madre, sia l´alimentazione che ovviamente modifiche genetiche in tale meccanismo.
INSULINA, DIABETE, SESSO ED AUTISMO
In supporto a questa ipotesi (Gardener, 2009) una recente meta-analisi dei fattori di rischio materni, ha associato un incremento di due volte per i casi di autismo a seguito dell´insorgenza di diabete gestazionale.
Anche se l´insulina non supera la barriera della placenta, l´elevato tasso di glucosio nel sangue del feto a causa del diabete materno, aumenta la produzione di insulina fetale e quindi aumenta l'attività dei circuiti neurologici coinvolti come il PI3K/Tor (di cui parleremo nella sezione apposita) implicato nella regolazione dell´ippocampo, memoria e controllo emotivo; e/o i fattori di crescita sinaptici come l´IGF-1 e l´IGF-2 (Rilkonen, 2006).
In uno studio recente (Schwartz, 2010) sono stati analizzati una serie di biomarkers che possono avere un ruolo nello sviluppo della Sindrome di Asperger. In particolare è stata studiata l´insulina, in quanto, dalla letteratura (Hana, 2004) si sa che è collegata ai fattori ormonali di crescita. Nei soggetti adulti non sono state trovate differenze significative nei livelli di insulina per quanto riguarda i maschi, mentre invece le donne hanno mostrato un incremento dell´80% rispetto ai soggetti di controllo (pur non arrivando ad una certezza statistica). Nel mentre, i livelli di glucosio sono stati rilevati come relativamente normali.
Ciò suggerisce che gli alti livelli di molecole collegate all´insulina siano dovuti ad una insulino-resistenza. E´ possibile ipotizzare che una stessa predisposizione genetica possa incidere e creare fenotipi adulti differenti interagendo con il sesso. In particolare problemi relativi al metabolismo dell´insulina sono frequenti nelle madri di persone autistiche. Nei maschi infatti si sono rilevati alti tassi di stress ossidativo che a loro volta sono legati (per via statistica) alla insulino resistenza e al diabete di tipo II durante lo sviluppo gestazionale.
L´IGF-1 (Katarzyna, 2011), fattore di crescita insulinico, è stato trovato alto nei livelli del plasma nei bambini autistici (Mills, 2007) ed è risaputo che incide sulle dimensioni corporee ed è legato alla crescita accelerata del cervello in modelli animali (Popken, 2004)
ASSOCIAZIONE CON ALTRE CONDIZIONI PSICHIATRICHE E FISICHE
Una delle possibilità evidenziate da numerosi studi è che almeno in parte i disturbi affettivi, l´Alzheimer e l´autismo siano associati attraverso la resistenza all´insulina (Rasgon, 2003). L´insulino resistenza con iper-insulinemia e il susseguente deficit nel metabolismo del glucosio possono indurre in alcuni pazienti una neuorodegenerazione legata allo stress ossidativo.
Un esempio della correlazione di questi comuni circuiti genetici e neurologici con l´insulina, derivano dall´uso dell´inositolo.
Come già citato nel paragrafo di apertura, L´inositolo (la vitamina B7 chiamata anche mesoinosite) è indispensabile per per il funzionamento dei mitocondri cellulari. Questi organelli cellulari oltre ad essere indispensabili per la produzione di energia rappresentano uno dei poli più importanti di disintossicazione della cellula.
L´inositolo è strettamente legato al metabolismo dell´insulina e studi recenti ne hanno dimostrato l´efficacia nella riduzione dei sintomi legati ad:
- ansia generalizzata
- panico
- agarofobia
- depressione bipolare (Chengappa, 2000;Silverstone, 2005),
- depressione (Levine, 1995),
- disturbo ossessivo-compulsivo (Fux, 1996)
- ovaio policistico (Nestler, 2000),
tutte condizioni che hanno una maggiore occorrenza in comorbidità con lo spettro autistico.
IL CIRCUITO NEUROLOGICO PI3K/TOR
Suggerimenti riguardo al ruolo dell´insulina vengono dagli studi di geni specifici in malattie genetiche che hanno una forte sintomatologia autistica. Queste malattie includono la Sclerosi Tuberosa (50% di persone affette da autismo), la Neurofibromatosi di tipo 1, la macrocefalia e l´X-Fragile (Stern, 2011). I geni coinvolti in questi disordini, Tsc1/Tsce, Nf1 e PTEN, rispettivamente, sono tutti geni che codificano inibitori di uno specifico percorso di segnalazione chiamato PIK3/mTor (Hay, 2004) o nel caso dell´eIF-4E, lo mediano.
Uno degli effetti dell´attività del PIK3/mTor è quello di aumentare la traslazione di mRNA e quindi una mutazione in questi 4 geni può di conseguenza aumentare l´incidenza dell´autismo.
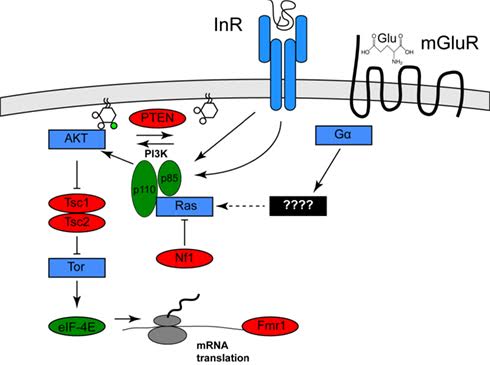
Figura 1. Attivazione del canale Pi3K/Tor da parte dell´insulina e del glutammato. (Stern, 2011), Le proteine in rosso sono inibitori e l´autismo è associato alla perdita di funzionalità in questi geni, le proteine in verde sono invece attivatori e l´autismo è associato con un´incremento di funzionalità in questi geni. Le proteine in blu rappresentano altri attivatori non (ancora) associati con l´autismo. Per chiarezza sono state omesse molte molecole intermedie.
In letteratura è altresì riportata più volte l´evidenza l´iperattivazione del circuito Pi3K/Tor in diversi casi di autismo a prescindere dalla presenza di una sindrome sottostante.
Recentemente (Neves-Pereira, 2009) ha suggerito la traslocazione di mutazioni puntuali nel genoma che rendono iperattivo l´eIF-4E come causa dell´autismo. Inoltre, studi sulle varianti nel numero di copie hanno trovato varianti che regolano il PI3K in eccesso nei casi di autismo rispetto a quanto aspettato per semplice coincidenza (Cuscò, 2009).
Nei neuroni la via di segnalazione PI3K/Tor è implicata in una forma di plasticità sinaptica, chiamata depressione a lungo termine (LTD) e mediata dai recettori del glutammato metabotropico (mGluR) (Bear, 2004). L´esempio migliore di ciò avviene nelle sinapsi tra i collaterali di Schaffer e le cellule piramidali CA1 dell´ippocampo, circuito collegato con l´apprendimento, la formazione e fissazione della memoria, nonché con la regolazione emotiva.
CONCLUSIONI
Variazioni nell´insulina attivano la via del PI3K/Tor in maniera simile alle mutazioni genetiche descritte nella sezione successiva, e la via del PI3K/Tor è quella prevalentemente coinvolta nella segnalazione intracellulare della stessa.
L´insulina può attraversare la barriera sangue-cervello e i sui recettori possono regolare l´attività delle siapsi in alcune zone del cervello di particolare rilevanza come l´ippocampo, il cervelletto e la corteccia prefrontale (Zhao, 2004;Zhao, 2006;Dou, 2005).
Da questo sembra che variazioni nell´insulina possano mimare le differenze funzionali che si presentano a seguito di variazioni genetiche in questo circuito e quindi in individui suscettibili geneticamente è possibile che le stesse giochino un ruolo importante nella presentazione clinica / peggioramento sintomatologico dell´autismo.
L´incidenza di diabete gestazionale e problemi metabolici:
- ipotiroidismo
- cistite
- ovarica etc..
è aumentata negli ultimi anni e può essere associata con una diminuzione nella tolleranza al glucosio nella popolazione generale, iper-insulinemia e un cambiamento nello stile e nelle condizioni di vita.
Anche se si suppone che l´aumento dell´incidenza di casi di ASD sia legata ad un miglioramento dei criteri diagnostici non è da escludere a priori che ci sia un contributo legato all´aumento di iper-insulinemia nella popolazione generale.
L´ipotesi quindi porta alla luce nuove possibilità di studi e terapie per gli interventi nell´autismo.
In particolare sarebbe opportuno condurre uno studio selezionando sia in base alla storia famigliare, sia in base ad esami di laboratorio, bambini ed adulti facenti parte dello spettro autistico, e validare o confutare i risultati riguardanti il possibile ruolo dell´insulina e di conseguenza verificare la validità di regimi dietetici, il possibile uso di integratori contenenti inositolo e la prevenzione durante la gravidanza.
Fonte: Insulina e autismo: una review degli studi degli ultimi 10 anni
Referenze
- Rilkonen, 2006:Riikonen R, Makkonen I, Vanhala R, Turpeinen U, Kuikka J, Kokki H (2006) Cerebrospinalfluid insulin-like growth factors IGF1 and IGF2 in infantile autism. Dev Med ChildNeurol 48(9): 751-5.
- Liberamente tratto da: Stern, 2011: Stern M., 2011, Insulin signaling and autism, Frontiers in Cellular Endocrinology 2:54.
- Schwarz, 2010:Schwarz, E. et al. Sex-specific serum biomarker patterns in adults with Asperger’s syndrome. Mol. Psychiatry 28.
- Hay, 2004: Hay N., Sonenberg N., Upstream and downstream of mTor.Genes Dev.18, 1926–1945.
- Levine, 1995: Levine et al.Double-blind, controlled trial of inositol treatment of depression,Am J Psychiatry.1995 May;152(5):792-4.
- Fux, 1996: Fux M., Levine J., Aviv A., Belmaker RH., Inositol treatment of obsessive-compulsive disorder, AM J Psychiatry, 153(9); 1219-21.
- Hana, 2004:Hana V, Silha JV, Justova V, Lacinova Z, Stepan JJ, Murphy LJ. The effects of GH replacement in adult GH-deficient patients: changes in body composition without concomitant changes in the adipokines and insulin resistance. Clin Endocrinol (Oxf); 60: 442–450.
- Katarzyna, 2011:Katarzyna et al.Early generalized overgrowth in boys with autism,Arch Gen Psychiatry.2011;68(10):1021-1031.
- Neves-Pereira, 2009: Neves-Pereira, M., Müller, B., Massie, D., Williams, J. H., O’Brien, P. C., Hughes, A., Shen, S. B., Clair, D. S., and Miedzybrodzka, Z. (2009). Deregulation of EIF4E: a novel mechanism for autism.J. Med. Genet.46, 759–765.
- Cuscò, 2009:Cuscó, I., Medrano, A., Gener, B., Vilardell, M., Gallastegui, F., Villa, O., González, E., Rodríguez-Santiago, B., Vilella, E., Del Campo, M., and Pérez-Jurado, L. A. (2009). Autism-specific copy number variants further implicate the phosphatidylinositol signaling pathway and the glutamatergic synapse in the etiology of the disorder.Hum. Mol. Genet.18, 1795–1804.
- Chengappa, 2000: Chengappa et al.Inositol as an add-on treatment for bipolar depression, Bipolar Disorder2:1,47-55.
- Ragunath, 2011:Ragunath et al.A systems biological study on the comorbidity of autism spectrum disorders and bipolar disorder,Bioinformation 7(3): 102-106 (2011).
- Bear, 2004:Bear, M. F., Huber, K. M., and Warren, S. T. (2004). The mGluR theory of fragile X mental retardation.Trends Neurosci.27, 370–377.
- Silverstone, 2005: Silverstone P.H., McGrath B.M., Kim H. Bipolar disorder and myo-inositol: a review of the magnetic resonance spectroscopy findings, Bipolar Disorders7:1, 1-10.
- Hartman, 2007: Hartman, A. L. and Vining, E. P. G. (2007),Clinical Aspects of the Ketogenic Diet. Epilepsia, 48:31–42
- Barano, 2008:K. W. Barañano and A. L. Hartman, “The ketogenic diet: uses in epilepsy and other neurologic illnesses,”Current Treatment Options in Neurology, vol. 10, no. 6, pp. 410–419.
- Volek, 2008: Volek, J. S., Fernandez, M. L., Feinman, R. D., and Phinney, S. D. (2008).Dietary carbohydrate restriction induces a unique metabolic state positively affecting atherogenic dyslipidemia, fatty acid partitioning, and metabolic syndrome.Prog. Lipid Res.47, 307–318
- Nestler, 2000: Nestler JE, Jakubowicz DJ, Iurno MJ, Role of Inositolphosphoglycan mediators of insulin action in the polycystic ovary syndrome, J Pediatr Enodcrinol Metab.; 13 Suppl 5:1295-B.
- Zhao, 2004: Zhao, W.-Q., Chen, H., Quon, M. J., and Alkon, D. L. (2004). Insulin and the insulin receptor in experimental models of learning and memory.Eur. J. Pharmacol.490, 71–81.
- Mills, 2007: Mills JL, Hediger ML, Molloy CA, Chrousos GP, Manning-Courtney P, Yu KF, Bras- ngton M, England LJ. Elevated levels of growth-related hormones in autism and autism spectrum disorder. Clin Endocrinol (Oxf ). 2007;67(2):230-237
- Popken, 2004: Ye P, Popken GJ, Kemper A, McCarthy K, Popko B, D’Ercole AJ. Astrocyte- specific overexpression of insulin-like growth factor-I promotes brain over- growth and glial fibrillary acidic protein expression. J Neurosci Res. 2004;78(4):472-484.
- Rasgon, 2003: Rasgon N., Jarvik L. (2003). Insuline Resistance, Affective Disorders, and Alzheimer´s Disease: Review and Hypothesis, Journal of gerontology A2:59,178-193.
- Gardener , 2009:Gardener, H., Spiegelman, D., and Buka, S. L. (2009). Prenatal risk factors for autism: comprehensive meta-analysis.Br. J. Psychiatry195, 7–14.
- Evangeliou , 2003:Evangeliou, A., Vlachonikolis, I., Mihailidou, H., Spilioti, M., Skarpalezou, A., Makaronas, N., Prokopiou, A., Christodoulou, P., Liapi-Adamidou, G., Helidonis, E., Sbyrakis, S., and Smeitink, J. (2003). Application of a ketogenic diet in children with autistic behavior: pilot study.J. Child Neurol.18, 113–118.
- Freeman, 2007: Freeman J. M., Kossoff E. H., Hartman A. L. (2007), The Ketogenic Diet: One Decade Later, Pediatrics 119, 535–543.


